ニュース&トピックス
2023.10.02 薬局での活用

日本調剤薬局店舗への展開 ~コラム Vol.8~
筆者プロフィール紹介

私は新卒で日本調剤に入社し、店舗勤務の後、ジョブチャレンジで病院派遣を経験しました。
病院ではDI室業務を担当させていただき、2年弱勤務していました。
初めての病院勤務、初めてのDI室で大変なこともありましたが、この時の経験が今のFINDAT事業部での業務に生かされていると思うことがたくさんあります。
さて、今回は、新薬の安全性について調べたい時にFINDATの新医薬品評価書がどう使えるのか?という話をしたいと思います。
FINDATでお薦めの機能tipsコーナー
皆さんは新薬の安全性やモニタリングが必要な項目について知りたいときにまずどの資料を確認するでしょうか?
添付文書やインタビューフォーム、リスク管理計画書(RMP)、メーカーのヒアリングだったり、適正使用ガイドがある薬剤なら適正使用ガイドも確認したりと、様々な情報源があると思います。
ただ、これらを全部調べたり、どの資料にどんな情報が載っているか把握するのは結構大変じゃないでしょうか?
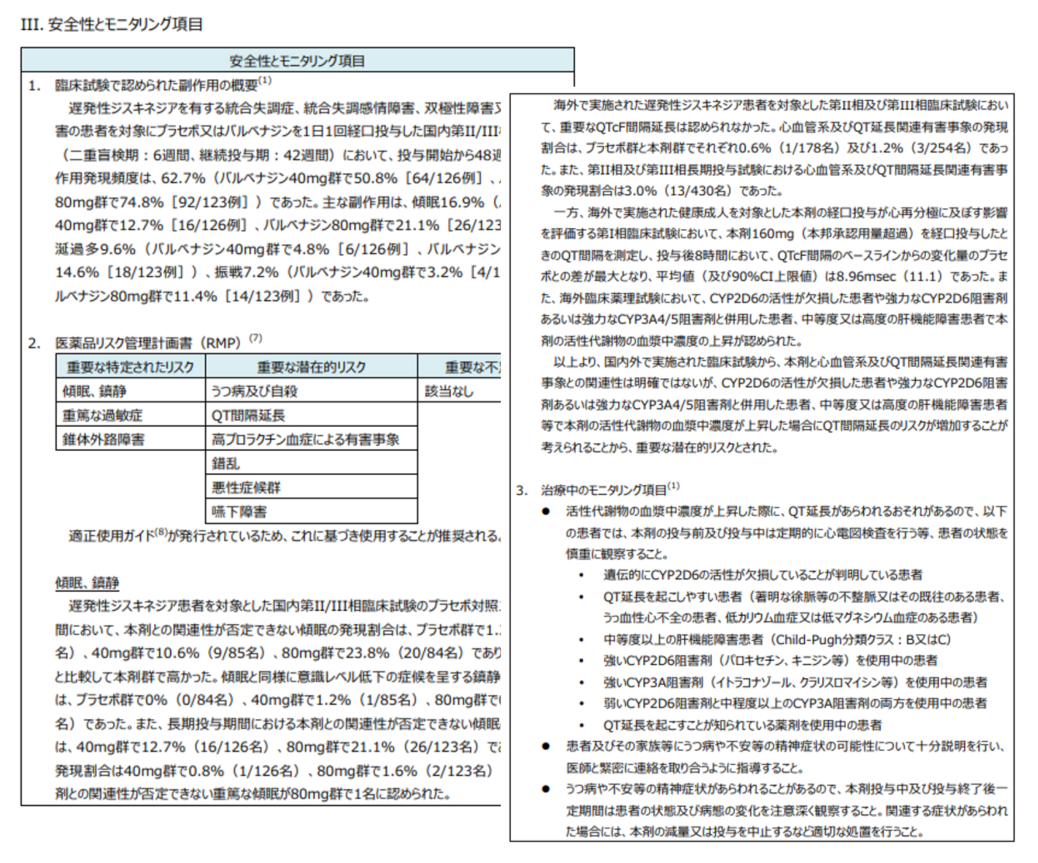
FINDATの新医薬品評価書には「III.安全性とモニタリング項目」という項目があり、ここでは添付文書、RMP、適正使用ガイドの情報が1か所にまとまっています。
「臨床試験で認められた副作用の概要」では、添付文書の掲載されている副作用の元になっている、臨床試験での副作用発現状況を掲載しています。
「医薬品リスク管理計画(RMP)」ではRMPで定められたリスクを一覧で確認でき、重要なリスクについての詳細はRMPの内容をより簡潔にわかりやすくまとめています。
「治療中のモニタリング項目」では、添付文書や適正使用ガイド等で挙げられているモニタリングが必要な項目がまとめられており、定期的な測定が必要な検査項目もまとめて確認できます。
また、新薬だけじゃなく、適応症が追加された医薬品の評価書にも同じ項目があります。追加された適応で新たに確認された副作用リスクなども確認できますし、市販後調査結果が公開されている薬剤ならそれも掲載しています。
細かい情報よりもざっくりとした概要を確認したいときや、他の同種同効薬との安全性の違いがあるのかを知りたいときは「VI.考察」の安全性に関する記載を読んでみるのもオススメです。
【新薬評価】ジスバルカプセル(2022年10月3日作成)

カテゴリー
合わせてお読みください
-
2023.11.08 薬局での活用

日本調剤グループ学術大会 ~FINDAT活用事例 ④~
FINDAT活用事例の紹介~乳がん術前化学療法中に出現した皮膚障害への対応~ 日本調剤グループでは毎年社内学術大会を開催しています。 2023年の学術大会では、
-
2023.01.23 薬局での活用

日本調剤薬局店舗への展開 ~コラム Vol.1~
筆者プロフィール紹介 私は2018年8月に日本調剤に中途入社し、店舗薬剤師として勤務していました。数店舗を経験した後、薬局店舗責任者を務めました。その後、社内公募に応募し、
-
2023.01.23 薬局での活用

日本調剤薬局店舗への展開
FINDATを薬局店舗に導入 FINDATは、弊社日本調剤の薬局店舗への導入も進めています。