適応症追加
概略

既に販売されている医薬品に臨床上の影響が大きい適応症が追加された場合に、当該適応症に対する医薬品の有効性・安全性等を評価します。
新たに承認を取得した適応症の中で、臨床上の影響が大きいものについて評価書を作成し、外部の薬剤師による査読を受けた上で公開しております。
原著論文、二次情報データベース、ガイドラインなど様々な情報源の中から必要な情報を集約しており、効率的に情報を入手できます。
適応症追加 掲載一覧
掲載中の全コンテンツ一覧はこちら
作成の流れ
-
STEP01
掲載医薬品の選定と情報収集
新規適応症が承認された医薬品を確認し、FINDATに掲載する医薬品を選択します。製薬会社へのヒアリングや文献等から情報収集します。
-
STEP02
評価書作成・内部査読
国内外の情報を広く収集し、医薬品評価書を作成します。
-
STEP03
外部査読
臨床で活躍している外部の薬剤師の査読により、情報や評価の妥当性を担保しています。
-
STEP04
FINDATに掲載
外部査読終了後、速やかにFINDAT上に掲載します。
資料の構成
適応症追加は、以下7つのパートから構成されています。
医薬品概要
効能・効果や用法・用量など、添付文書およびインタビューフォームに掲載のある基本事項を集約しています。
臨床で遭遇することの多い肝機能・腎機能低下時の用量調整(禁忌や減量など)に関する情報もまとめています。
また、国内添付文書では不足しがちな妊婦・授乳婦の情報については、海外の添付文書、オーストラリア分類及びHale分類などで補足しています。
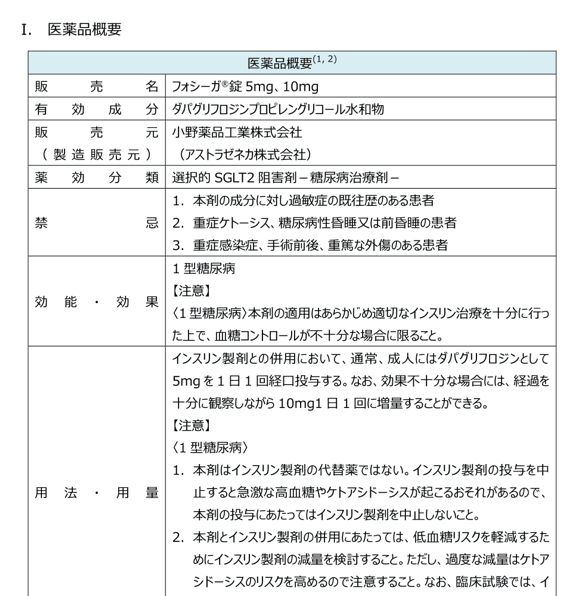
ピンチアウトで拡大できます
有用性に関する臨床的エビデンス
申請時に評価対象となった臨床試験の概略をまとめています。
- 試験デザイン
- 対象患者(選択基準、除外基準)
- 患者背景
- 主要評価項目
- 結果 など
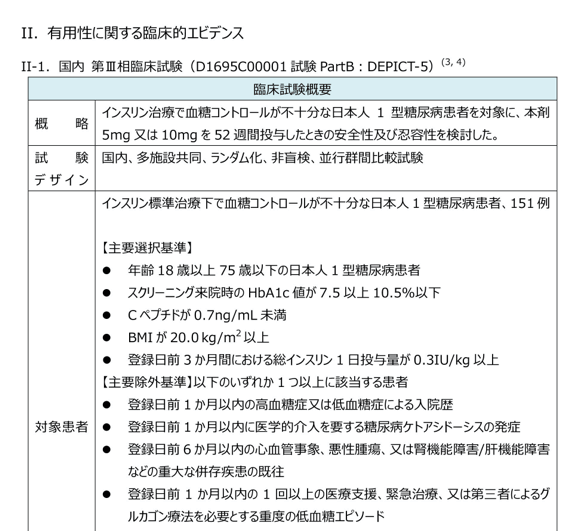
ピンチアウトで拡大できます
安全性とモニタリング項目
副作用や使用に当たって注意すべき項目を記載しています。
臨床試験の副作用発現率、医薬品リスク管理計画書に設定されているリスクに関する情報に加え、ガイドラインに記載のある安全性に関する注意事項についても掲載しています。

ピンチアウトで拡大できます
ガイドラインでの推奨
評価対象薬に関するガイドラインでの評価をまとめています。
国内の情報が限られる場合は、海外の主要なガイドラインでの記載についても掲載しており、評価対象薬の特徴や海外での立ち位置について情報を得ることができます。
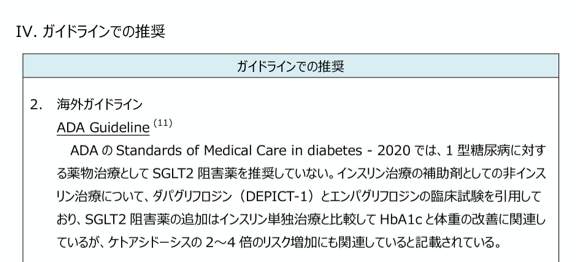
ピンチアウトで拡大できます
経済性
薬価と承認された用法用量で使用した際の参考金額を掲載しています。
評価対象薬と同種同効薬(後発医薬品を含む)に関する情報を一覧表で示しています。
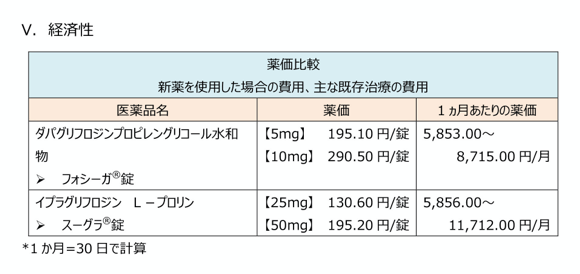
ピンチアウトで拡大できます
考察
評価対象薬に関する総評を記載しています。
評価対象薬の使用が適する患者、使用にあたっての留意点、臨床上の必要性などをまとめています。
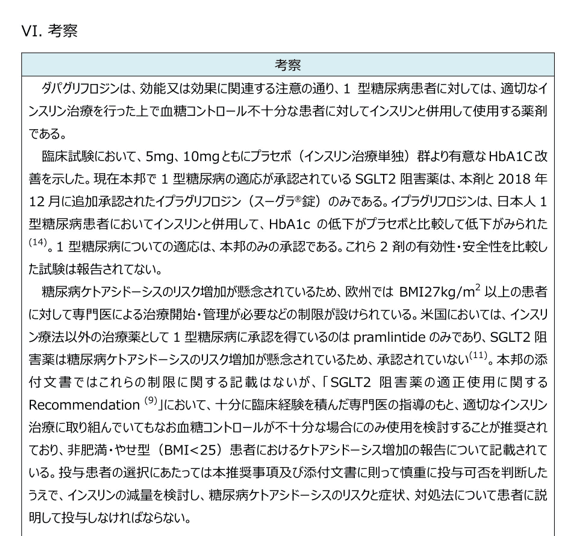
ピンチアウトで拡大できます
参考文献
引用文献を記載しています。
論文のリファレンスにはPMIDを併記していますので、原著の検索が容易です。ガイドラインにはハイパーリング付きのURLを併記していますので、原文にもすぐアクセスできます。
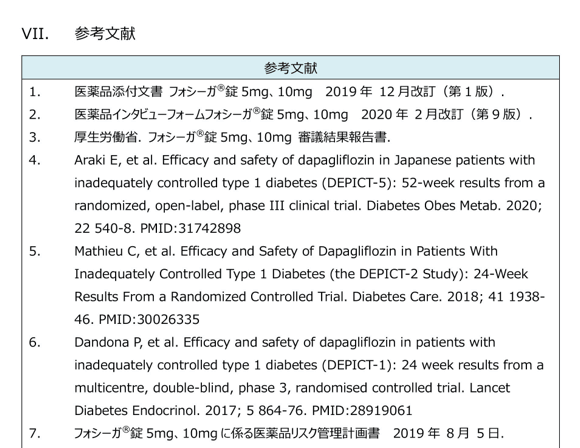
ピンチアウトで拡大できます
お客様の声
モニターアンケートでのお客様からのご意見を抜粋しております。
-

ガイドラインの記載と併せて記載されており参考になった。
ニュース&トピックス
-
2025.06.02 FINDAT
FINDATがリリースから5周年!
2025年6月1日にFINDATがリリースから5周年を迎えました。 この素晴らしい節目を迎えることができましたのも、ひとえに、FIN
-
2025.04.25 フォーミュラリー

フォーミュラリーに関する臨床研究のご紹介⑥
フォーミュラリーに関する臨床研究はすでに数多く発表されていますが、今後は本サイトにて、特に興味深い臨床研究をご紹介していきます! 常勤精神科医の配置がない急性期一般総
-
2025.04.24 活動報告

2025年度 実務実習を実施しました
日本調剤の実務実習 2025年4月に実施された日本調剤の薬局実務実習の一環として、医療戦略推進部FINDATオペレーションチームから次世代を担う薬学生に向けて講義を行いました