新薬評価
概略

承認後間もない医薬品の中から臨床での影響が大きい品目を選択し、科学的根拠に基づいて評価を行った資料です。
新薬採用時や、新薬の使用を考慮する際の資料としてご活用いただけます。
新たに製造販売承認を取得した医薬品の中で、臨床上の影響が大きい製品について評価書を作成し、公開しています。製品基本情報や原著論文、二次情報データベース、ガイドラインなどから必要な情報を集約しています。
新薬採用時の資料としてそのままご活用いただけます。
新薬評価 掲載一覧
掲載中の全コンテンツ一覧はこちら
作成の流れ
-
STEP01
製薬会社へのヒアリングと情報収集
製造販売承認された時点から、製薬会社へのヒアリングと文献等の情報収集を開始し、評価書作成に取り掛かります。
-
STEP02
評価書作成・内部査読
国内外の情報を広く収集し、医薬品評価書を作成します。
-
STEP03
外部査読
臨床で活躍している外部の薬剤師の査読により、情報や評価の妥当性を担保しています。
-
STEP04
FINDATに掲載
新医薬品評価書は原則、製造販売承認後6か月以内にFINDATに掲載します。
資料の構成
新薬評価は、以下7つのパートから構成されています。
医薬品概要
効能・効果や用法・用量など、添付文書およびインタビューフォームに掲載のある基本事項を集約しています。
臨床で遭遇することの多い肝機能・腎機能低下時の用量調整(禁忌や減量など)に関する情報もまとめています。
また、国内添付文書では不足しがちな妊婦・授乳婦の情報については、海外の添付文書、オーストラリア分類及びHale分類などで補足しています。
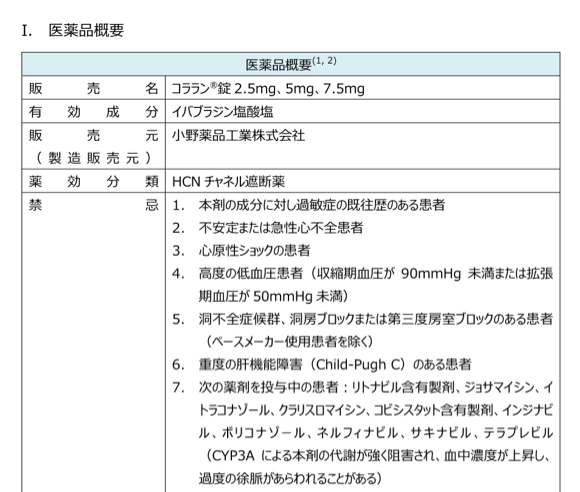
ピンチアウトで拡大できます
有用性に関する臨床的エビデンス
申請時に評価対象となった臨床試験の概略をまとめています。
- 試験デザイン
- 対象患者(選択基準、除外基準)
- 患者背景
- 主要評価項目
- 結果 など

ピンチアウトで拡大できます
安全性とモニタリング項目
副作用や使用に当たって注意すべき項目を記載しています。
臨床試験の副作用発現率、医薬品リスク管理計画書に設定されているリスクに関する情報に加え、ガイドラインに記載のある安全性に関する注意事項についても掲載しています。

ピンチアウトで拡大できます
ガイドラインでの推奨
新薬や同種同効薬に関するガイドラインでの評価をまとめています。
国内の情報が限られる場合は、国外の主要なガイドラインでの記載についても掲載しており、新薬の特徴や国外での立ち位置について情報を得ることができます。

ピンチアウトで拡大できます
経済性
薬価及び承認された用法用量で使用した際にかかる参考金額を掲載しています。
同種同効薬(後発医薬品を含む)の薬価・参考金額も一覧表形式で示しています。
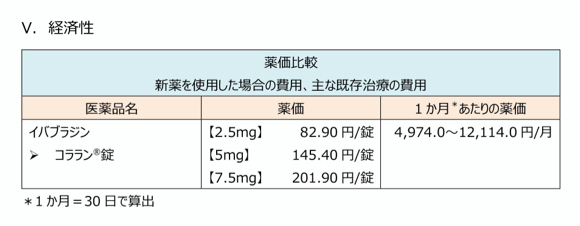
ピンチアウトで拡大できます
考察
新薬に関する総評を記載しています。
新薬の使用が適する患者、使用にあたっての留意点、臨床上の必要性などをまとめています。

ピンチアウトで拡大できます
参考文献
引用文献を記載しています。
論文のリファレンスにはPMIDを併記していますので、原著の検索が容易です。ガイドラインにはハイパーリンク付きのURLを併記していますので、原文にもすぐアクセスできます。
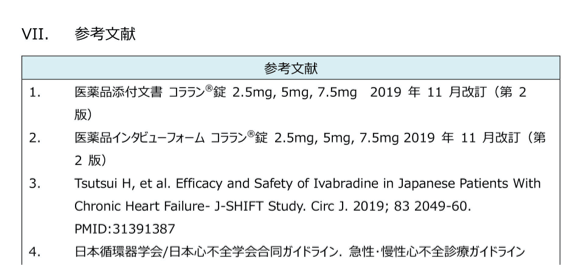
ピンチアウトで拡大できます
お客様の声
モニターアンケートでのお客様からのご意見を抜粋しております。
-

PMDA に掲載されている情報が簡潔にまとめられており、これらの情報を十分読み込む時間のない医師や薬剤師には有用だと思います。
-

臨床試験から経済性までのっていて
とても参考になります。 -

医薬品情報の評価としては素晴らしく、良くまとまっています。薬事委員会で審議する資料のとりまとめ作業も軽減すると思います。
-

考察の項目などは採用申請時における採用可否の一助になると考えられる。
ニュース&トピックス
-
2025.07.15 フォーミュラリー検討有識者委員会

第33回フォーミュラリー検討有識者委員会
第33回フォーミュラリー検討有識者委員会 審議結果 第33回フォーミュラリー検討有識者委員会の審議結果をお知らせいたします。 FINDATへの掲載情報は随時ご案
-
2025.06.02 FINDAT
FINDATがリリースから5周年!
2025年6月1日にFINDATがリリースから5周年を迎えました。 この素晴らしい節目を迎えることができましたのも、ひとえに、FIN
-
2025.04.25 フォーミュラリー

フォーミュラリーに関する臨床研究のご紹介⑥
フォーミュラリーに関する臨床研究はすでに数多く発表されていますが、今後は本サイトにて、特に興味深い臨床研究をご紹介していきます! 常勤精神科医の配置がない急性期一般総